Небольшое пространство без окон в Детской больнице Филадельфии похоже на кабинет для осмотра любого окулиста с регулируемым стулом и полдюжиной машин для проверки зрения. 20-летний пациент, однако, не приехал из Альбукерке, чтобы получить новые очки. Алиша Бакоккини с короткими светлыми волосами и зелеными глазами родилась с расстройством, вызванным неисправным геном в ее клетках сетчатки, который с рождения ухудшал ее зрение. Теперь она видит только бледные и размытые формы. «Если я смотрю на тебя, я не вижу цвета глаз, прыщей или твоих бровей, но я вижу, что кто-то там есть», - говорит она. Ее собака-поводырь Тундра, черный лабрадор, сидит у ее ног.
Из этой истории
[×] ЗАКРЫТЬ
Двое из выдающихся исследователей генной терапии надеются улучшить зрение своих пациентов в экспериментальной операции
Видео: Эксперты по генной терапии смотрят вперед в лечении слепоты
Связанный контент
- Музыкальные плейлисты, чтобы успокоить ваш ум
- Высокие надежды на новый вид гена
Месяцем ранее, в ходе экспериментального лечения, исследователи ввели правому глазу Бакоккини - худшему - миллиарды рабочих копий гена клеток сетчатки. Теперь они узнают, сработало ли лечение.
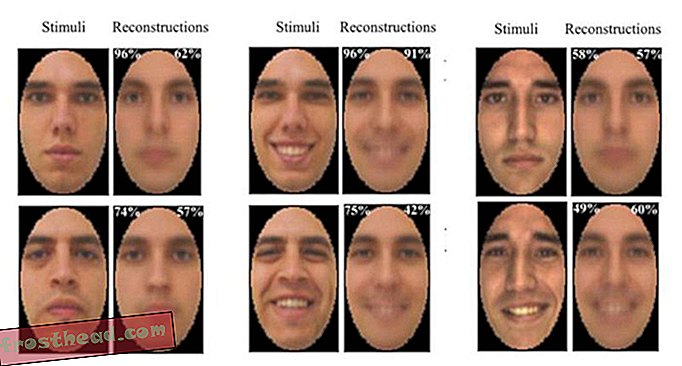
Джин Беннетт, врач и специалист по молекулярной генетике, заставила Бакоккини прислониться лбом к маленькой белой машине, которая излучает свет в один глаз, а затем в другой. Этот зрачок покажет, насколько хорошо глаза Бакоккини реагируют на свет. «Хорошо, раз, два, три, открой», - говорит Беннетт и повторяет процедуру 16 раз. На экране компьютера в затемненной комнате зрачки Бакоччини представляют собой два гигантских черных круга, которые с каждым импульсом света сжимаются. Другой исследователь сопровождает Бакоккини к следующему испытательному аппарату. Спустя полчаса Беннетт говорит: «Я только что посмотрел на ваши результаты пупиллометрии. Хорошее улучшение».
«Это хорошо», - говорит Бакоккини, хотя звучит неуверенно. По ее словам, спустя несколько дней после инъекции, она действительно видела больше света из этого глаза, но все кажется более размытым. Когда она пытается прочитать гигантскую диаграмму глаз своим правым глазом, она не лучше, чем раньше - она может выделить только несколько букв высотой два дюйма с расстояния в 16 дюймов. Опять же, ее глаз все еще красный от операции. Муж Беннетта, Альберт Магуайр, является хирургом сетчатки, который прооперировал Бакоккини. Он смотрит ей в глаза и говорит, что поверхность еще не зажила, добавляя: «Надеюсь, это все, что есть».
Перспектива использования генной терапии для лечения заболеваний, в частности наследственных заболеваний, в которые вовлечен один ошибочный ген, таких как серповидноклеточная анемия и муковисцидоз, привлекала ученых в течение десятилетий. Если бы был какой-то способ дать пациенту хорошую версию замешанного гена, думает он, он может восстановить или предотвратить повреждение, вызванное унаследованным плохим геном. Эта, казалось бы, простая идея оказалась на практике неожиданно сложной. За последние 18 лет были проведены сотни испытаний человеческой генной терапии для лечения многих заболеваний, от гемофилии до рака. Но почти все не удалось из-за трудностей с получением рабочего гена в клетки, не вызывая также вредных побочных эффектов.
До прошлого года генная терапия однозначно работала против только одного заболевания, редкого заболевания, называемого тяжелым комбинированным иммунодефицитом (SCID), которое вызвано дефектом любого из ряда генов, необходимых для продуцирования лейкоцитов. Болезнь оставляет иммунную систему неспособной бороться с инфекциями и обычно приводит к смерти в детстве. Это также называют болезнью "пузыря мальчика", после одного известного пациента, Дэвида Веттера, который жил до 12 лет в стерильном пластмассовом пузыре. С середины 1990-х годов европейские исследователи вылечили около 30 детей с помощью SCID, введя соответствующий функционирующий ген в их костный мозг. Но даже этот успех был смешан с трагедией: у пятерых детей развился лейкоз и один умер. У тех пациентов, у которых был конкретный вариант заболевания, терапевтический ген случайно включил ген, вызывающий рак, после слияния с ДНК пациента. В настоящее время исследователи испытывают способы сделать генную терапию для SCID более безопасной.
Исследования в области генной терапии в США были существенно отложены после того, как 18-летний Джесси Гелсингер, который страдал от наследственного заболевания печени, умер от полиорганной недостаточности в 1999 году, участвуя в эксперименте по генной терапии в Университете Пенсильвании. Известие о смерти вызвало шум в научном сообществе и слушания в Конгрессе, когда отец подростка, Пол Гелсингер и другие, обвинили исследователей из Пенсильвании в том, что они слишком поспешны, чтобы протестировать лечение на людях. По данным Управления по контролю за продуктами и лекарствами, исследователи недостаточно предупредили Гелсингера и его семью о рисках эксперимента. Ведущий исследователь также не смог раскрыть, что у него есть финансовая доля в компании, которая выиграет, если лечение будет успешным. «Это были ужасные дни. Область достигла дна», - говорит Леон Розенберг, генетик из Принстонского университета, который проводил ранние лабораторные исследования заболеваний печени, которые были у Гелсингера. «Целостность науки была сильно повреждена».
Беннет и Магуайр поступили в медицинский факультет Пенна в 1992 году. Один из их коллег - Джеймс Уилсон, который руководил исследованием, в котором умер Гелсингер. Впоследствии FDA запретил Уилсону проводить эксперименты на людях. Но Беннет и Магуайр не были вовлечены в это исследование. Их экспериментальное исследование по генной терапии началось в 2007 году после нескольких лет рассмотрения федеральными регуляторами, комитетами детской больницы и Пенна, созданными для решения этических вопросов и вопросов безопасности, вызванных смертью Гелсингера.
В мае этого года их команда и отдельная британская группа сообщили о первых обнадеживающих новостях в области генной терапии за последние годы: техника может лечить слепоту. Пациенты в исследовании имели болезнь под названием врожденный амавроз Лебера (LCA). Три пациента, которых лечили Беннетт и Магуайр, смогли прочитать на несколько строк в диаграмме глаза больше, чем могли раньше. Один 26-летний мужчина даже обрел достаточное зрение, чтобы пройти через лабиринт. «Я не мог в это поверить», - говорит Беннет. Она заставила его снова пройтись по лабиринту.
Исследование было небольшим, и пациенты по-прежнему юридически слепы, но их скромное улучшение и очевидная безопасность терапии вызвали надежды пациентов и исследователей по всему миру. Теперь Беннет и Магуайр расширяют исследование для большего количества пациентов с ДМС, включая Бакоккини, чтобы проверить, могут ли пациенты безопасно получать более высокие дозы терапевтического гена.
Розенберг говорит, что он «в восторге» от Беннетта, который в 1987 году был докторантом в своей лаборатории, и в этой области. «Я снова с оптимизмом смотрю на генную терапию, и я давно не был», - говорит он. «Надеюсь, до конца этого десятилетия будет два или три других примера».
И для Беннетта, 54 года, и для Магуайра, 48 лет, наука, похоже, находится в их генах. Мать Беннетта, Фрэнсис, преподавала литературу в средней школе, а ее отец, Уильям, был популярным профессором физики в Йельском университете, который изобрел газовый лазер в 1960 году, работая в Bell Labs в Нью-Джерси. Беннетт вспоминает, как ей было 6 лет, и она видела, как ее отец бежит обратно в лабораторию после обеда на работу до рассвета; позже устройство привело к проигрывателям компакт-дисков и сканерам цен в супермаркетах.
Она больше интересовалась биологией, чем физикой. «Я любила существ», - говорит она, и провела много счастливых часов, глядя в микроскоп отца на болотную воду и листья. После колледжа в Йельском университете она поступила в Калифорнийский университет в Беркли, чтобы получить степень доктора биологии развития, используя морских ежей, но вместо этого ее привлекли к новым исследованиям по включению специфических чужеродных генов в мышей и других животных - предшественника генная терапия. Она провела несколько месяцев в 1981 и 1983 годах в Национальном институте здравоохранения в Бетесде, штат Мэриленд, в лаборатории, где ученые планировали некоторые из первых испытаний генной терапии. «Это был проблеск того, что это должно было произойти, что меня взволновало. Я хотел быть там по мере разработки месторождения», - вспоминает Беннетт. Чтобы получить необходимое клиническое образование, она пошла в Гарвардскую медицинскую школу, где встретилась со своим будущим мужем на первом курсе анатомии.
Магуайр также происходил из семьи ученых. Его отец, Генри, был дерматологом и в настоящее время является исследователем противораковой вакцины в Пенне, а его мать, Элиз, работала там ассистентом исследователя. У Генри были катаракта и позднее отслоение сетчатки. Когда Магуайр учился в старших классах, он применял глазные капли отца - самый ранний шаг в офтальмологическом лечении. В медицинской школе Магуайр работал в лаборатории, которая изучала заболевания сетчатки, вызванные наследственными дефектами генов. Он помнит, как тогда спрашивал Беннетта, можно ли исправить плохие гены. «Это имеет смысл», - сказала она ему. "Давай сделаем это."
Глаз особенно хорошо подходит для генной терапии. Клетки, в которые должен быть вставлен новый ген, ограничены небольшой областью; сетчатка содержит всего несколько миллионов клеток. Более того, в отличие от большинства клеток, клетки сетчатки не делятся после того, как человеку исполнилось 3 месяца, поэтому исследователям не нужно вводить новый ген в клетки будущих поколений. Это означает, что им не нужно встраивать новый ген в существующую ДНК клеток, которая реплицируется при делении клетки. Хранить терапевтический ген отдельно от ДНК пациента более безопасно; у пациентов с SCID, у которых развилась лейкемия, введенный ген был включен рядом с геном, вызывающим рак, и случайно включил его. Глаз также защищен от иммунитета, что означает, что иммунная система имеет тенденцию игнорировать инородный материал, введенный туда. Побег иммунного ответа был проблемой в некоторых испытаниях генной терапии, и именно это убило Джесси Гелсингера. «Нам очень повезло с выбором целевого органа», - говорит Магуайр.
В то время как Магуайр обучалась, чтобы стать хирургом сетчатки, Беннет продолжала специализироваться на исследованиях, а не на клинической работе, следуя за своим мужем по всей стране за его стажировкой, резидентурой и стипендией. Сложные дела, они путешествовали с малышами. На последнем курсе медицинской школы у молодоженов родился первый ребенок - «наш старший проект», как они его называют. Вскоре последовали еще двое детей.
В 1989 году, во время одной из последних тренировочных остановок Магуайра, в Ройал-Оукс, штат Мичиган, Беннет создал временные лаборатории в здании по соседству с больницей и в подвале их дома. Они провели, как они думают, первый эксперимент по генной терапии с участием сетчатки. Используя мышей и кроликов, они вводили ген фермента, обнаруженного в бактериях. Они использовали краситель для выявления того, создал ли глазные клетки фермент, и эксперимент удался: сетчатки животных посинели в течение примерно двух недель.
В Penn они опубликовали одну из первых двух работ, показывающих, что вирус, наделенный чужеродным геном, может проникнуть в ткани глаза, в данном случае у мышей. (Эта стратегия, распространенная в экспериментах по генной терапии, по существу использует способность вируса к репликации путем введения своего собственного генетического материала в клетки.) Беннет и Магуайр позже вставили терапевтические гены в глаза некоторых ирландских сеттеров с наследственной слепотой. Но Беннетт думал, что улучшение в собаках не было достаточно убедительным, чтобы оправдать человеческое испытание. Им нужна была простая, медленно прогрессирующая форма слепоты, которая была связана с болезнью, которая поражает людей. В 1998 году они узнали о породе бриар собак в Швеции с заболеванием глаз, которое, по счастливой случайности, было вызвано одной из генетических мутаций, обнаруженных у некоторых пациентов с ДМС.
Около 3000 человек в Соединенных Штатах страдают от LCA, которая охватывает несколько различных нарушений слепоты, которые начинаются в детстве и вызваны мутациями в любом из нескольких генов, один из которых называется RPE65. Он содержит инструкции по ферменту, важному для светочувствительных клеток сетчатки, палочек и колбочек; Этот фермент превращает витамин А в форму, которую используют палочки и колбочки для получения необходимого пигмента, родопсина. У людей, которые наследуют плохую копию гена RPE65 от каждого родителя, палочки и колбочки, лишенные родопсина, выходят из строя и в конечном итоге умирают.
Беннетт, Магуайр и его коллеги использовали вирус, называемый адено-ассоциированным вирусом, чтобы вставить хорошую копию гена RPE65 в трех молодых бриардов. Два гена вируса AAV были заменены геном RPE65 плюс цепочка ДНК, которая включает ген. Собаки обрели достаточное зрение, чтобы ориентироваться в лабиринте. «Это было фантастически захватывающе, - говорит Беннетт. Одна собака, Ланселот, стала своего рода собакой-поводырем для генной терапии, тряся лапами с людьми на пресс-конференциях и сборах средств.
На тротуаре возле своего офиса Беннетт демонстрирует одну из более чем 50 собак, которых они лечили. Венера, бриар среднего размера с коричневыми волнистыми волосами, напрягается на поводке и явно хочет убежать, но она сидит, чтобы позволить посетителю погладить ее. «Когда она пришла сюда, она ничего не видела. Она присела бы в углу или в клетке, обнажая зубы перед людьми», - говорит Беннетт. Это было год назад, до того как команда Беннетта / Магуайра лечила генной терапией тогдашнего годовалого ребенка на оба глаза. Хотя Венера еще не спала ночью, она теперь может прыгать через препятствия, разбросанные по коридору, и ловить теннисный мяч. «Ее поведение изменилось», - говорит Беннетт. «Она хорошо видит оба глаза. Она очень счастливая собака».
Когда они впервые попробовали лечение на людях, Беннетт и Магуайр не ожидали, что их пациенты улучшатся так же, как собаки. Во-первых, врачи сначала проверяли безопасность и использовали низкие дозы вируса и гена. И их первыми пациентами, все из офтальмологической клиники в Италии, которые проверяют слепых пациентов на генетические дефекты, были 26-летние близнецы и 19-летний. К тому времени у пациентов с ДМС не осталось большого количества ткани сетчатки. Большинство полностью слепы к 40 годам.
Тем не менее, Беннет и Магуайр не знали, чего ожидать, когда лечили первого пациента, одного из близнецов. Он был анестезирован, затем Магуайр сделал несколько небольших надрезов и заменил гелеобразный стекловидный материал в глазу человека солевым раствором, чтобы Магуайр мог легче проходить через него иглу. Используя микроскоп, он продел тонкую иголку через белизну глаза, пока она не коснулась сетчатки. Он ввел 150 мкл раствора (капля размером с горошину), который содержал 15 миллиардов копий вируса AAV с геном RPE65. Вирус считается чрезвычайно безопасным механизмом доставки - он не может размножаться сам по себе и не вызывает заболевания у людей.
Тем не менее, в ту ночь «я совсем не спал», - говорит Магуайр, который беспокоился о иммунной реакции. К его облегчению, не было ни одного.
Несмотря на то, что доза была низкой, Беннетт говорит, что в первый раз, когда она посмотрела на данные пупиллометрии молодого человека, это был «момент Эврики» - его глаз мог чувствовать больше света. Через несколько месяцев после экспериментальной терапии все три пациента увидели больше света. Двое, которые раньше могли видеть только движения рук, могли прочитать три или четыре строки глазной карты.
Беннетт говорит, что у всех трех пациентов зрение все еще улучшается. 19-летнему, который вернулся в Италию, больше не нужна помощь, чтобы ходить по ночам.
Когда Алиша Бакоккини родилась, ее мать, Ева Скидмор, сразу же поняла, что что-то не так. Кажется, Алиша сосредоточилась только на ярком свете, например, на окне или лампе. Она думала, что ее дочери могут просто понадобиться очки, но офтальмолог сказал, что маленькая девочка ослепла и ничего не поделаешь. Ей был поставлен диагноз прогрессирующее заболевание глаз в 11 месяцев, и генетический тест в конечном итоге идентифицировал заболевание как ДМС. В детстве Алиша все еще видела достаточно хорошо, чтобы играть в футбол с белым мячом на зеленой траве. «Она была очень быстрой, - говорит Скидмор, что компенсировало то, что мяч не был виден в воздухе. Примерно в восьмом классе Алиша потерял даже это ограниченное зрение.
Сегодня она может читать текст на ярком экране компьютера, но не в книге. Она работает массажистом. Если бы она могла лучше видеть, ее работа мечты состояла бы в том, чтобы работать судебно-медицинским патологом - она пожирает романы Патрисии Корнуэлл на ленте. Скидмор хочет, чтобы ее дочь смогла восстановить достаточно зрения, «чтобы увидеть звезды на небе и радугу, потому что она никогда не видела этого».
Бакоккини говорит, что понимает, что ее зрение может не улучшиться в исследовании генной терапии, а может даже ухудшиться. По ее словам, она вызвалась принять участие, чтобы «помочь разобраться, как устранить слепоту».
Через три месяца после того, как Магуайр ввел в глаза Бакоккини вирусы, несущие ген сетчатки, ее глаза были в десять раз более чувствительны к свету, и ее периферическое зрение улучшилось, но она не могла читать карту глаз лучше, чем раньше. Беннетт говорит, что есть несколько причин, по которым лечение может быть ей неэффективным - например, нервные цепи между глазом и мозгом Бакоккини могут перестать функционировать должным образом.
Bacoccini является частью второй фазы исследования, которая дала трем пациентам с LCA большую дозу генной терапии, чем первые три добровольца. Один из других пациентов в группе Бакоккини - 9-летний бельгийский мальчик, который продемонстрировал некоторые из самых драматических улучшений. Он может видеть детали лиц в первый раз и больше не нуждается в специальном увеличительном устройстве, чтобы видеть классную доску в школе. Чем моложе пациент, считают Беннетт и Магуайр, тем больше шансов, что пара реверсирует слепоту, вызванную LCA. В конце концов они надеются лечить детей.
Биомедицинские исследования часто вовлекают большие группы сотрудников, но исследования генной терапии - крайний случай. В прошлогодней статье в Медицинском журнале Новой Англии, в которой сообщалось о первоначальном успехе генной терапии слепоты, перечислили 32 соавтора: от молекулярных биологов, которые разработали вирус, до итальянских врачей, которые нашли пациентов. Беннет, ведущий автор, руководит этой группой из небольшого офиса за пределами ее лаборатории. Пространство заполнено тетрадями и папками и украшено фотографиями трех ее детей, обложками журналов и несколькими фотографиями Ланселота, которому сейчас 8 лет, и он до сих пор хорошо видит.
Магуайр утверждает, что его роль в том, чтобы делать инъекции пациентам, незначительна: «Я просто загружаю грузовики». Но он, в конце концов, один из клинических экспертов. «С [наследственными заболеваниями слепоты] существует огромное эмоциональное наложение», - говорит он. «Врачи всегда считали их неизлечимыми и говорили пациентам, что мы ничего не можем для вас сделать. Тот факт, что это работает, чрезвычайно интересен».
Успех процесса LCA привлек Беннетта и Магуайра к себе большое внимание - «неудобное количество внимания», говорит он, - включая приглашения от членов Конгресса, чтобы проинформировать их о работе. Но дуэт, кажется, принимает это с ходу. Беннетт ежедневно отправлял полдюжины телефонных звонков и электронных писем от слепых пациентов или их родителей, которые слышали об исследовании LCA. «Я отвечаю на них все. Все эти люди очень, очень расстроены из-за того, что ослепли или ослепли», - говорит она. Безусловно, они вряд ли вписываются в исследование LCA, потому что у них нет правильного генетического сбоя. Но она все равно говорит им пройти тестирование на гены слепоты, потому что генная терапия их болезни может появиться через несколько лет.
Вскоре Магуайр и Беннетт ожидают начать эксперименты с абиссинскими кошками с LCA, вызванной мутацией гена, отличной от той, на которой они сосредоточены до сих пор. Они также планируют клиническое исследование генной терапии для формы болезни Старгардта или ювенильной макулярной дегенерации, которая поражает около 25 000 человек в Соединенных Штатах и которую они успешно лечили на мышах, спроектированных для лечения этой болезни. Теперь, когда было доказано, что генная терапия может быть безопасно проведена в глазу, компании изучают способы использования этой техники для лечения заболеваний, которые не обязательно имеют генетическое происхождение. Например, введение гена, который контролирует рост кровеносных сосудов, может замедлить возрастную дегенерацию желтого пятна, от которой страдают более десяти миллионов американцев.
Несмотря на высокие успехи в медицине, Беннет и Магуайр едут работать на избитых десятилетних автомобилях. Дома она отдыхает, занимаясь садоводством и играя на рояле своей бабушки, и он рисует подробные, фермерские сцены в стиле народного искусства, изображая «каждую травинку», говорит Беннетт. («Существует небольшое обсессивно-компульсивное расстройство», - объясняет Магуайр о своих увлечениях.) Их младший ребенок ушел в колледж, но им нужны две собаки, аквариум с рыбами и черепахами и около 15 зябликов - последнее увлечение Магуайра - наблюдение поведение птицы. Семья "имеет высокий порог для беспорядка", говорит Магуайр.
Беннетт не спит ночью, пишет отчеты и предоставляет заявки, а также планирует новые эксперименты. Она так же увлечена, как и ее отец, когда работал над газовым лазером. «Это невероятное волнение, которое ты собираешься преодолеть в чем-то», - говорит она.
Джоселин Кайзер освещает биомедицинские исследования и политику в журнале Science .
Стивен Восс недавно сфотографировал ухудшение состояния окружающей среды в Китае. Оба живут в Вашингтоне, округ Колумбия